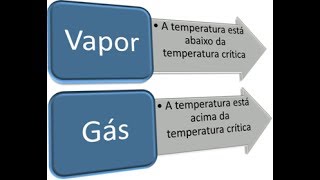
Principal diferença
As pessoas acham difícil dizer a diferença entre gás e vapor, pois o último também é um tipo de gás e não é rotulado como qualquer outro estado separado da matéria. O gás é o estado da matéria que tem a menor atração intermolecular entre suas moléculas e é invisível a olho nu. Ao contrário disso, o vapor é o estado de equilíbrio entre gases e líquido, que pode retornar à sua forma líquida original após a pressão ser exercida sobre ele e a temperatura ser mantida constante. Aqui deve-se notar que o material gasoso que obtemos de líquidos no estado de equilíbrio é conhecido como vapor. O material gasoso que obtemos da água (líquido) é conhecido como vapor de água, não como gás de água.
Quadro comparativo
O que é gás?
O gás é classificado como um dos quatro estados da matéria; têm a característica distintiva de ocupar o espaço disponível independentemente da forma e do volume. Essa característica se deve à presença de muito pouca atração intermolecular entre as moléculas. Os outros três estados da matéria são sólido, líquido e plasma. Os sólidos têm forma e volume fixos, enquanto os líquidos têm volume fixo, mas não possuem a característica de forma fixa; eles assumem a forma do recipiente em que são despejados. As moléculas de gás movem-se constantemente de forma independente devido à fraca força atrativa entre as moléculas. O gás pode encher qualquer recipiente de tamanho, uma vez que as moléculas de gás estão em constante movimento. Os compostos que ainda permanecem no estado gasoso são classificados como gasosos. Por exemplo, o dióxido de carbono é classificado como um gás, isso porque permanece um gás mesmo à temperatura ambiente, ou seja, podemos dizer que o CO2 nunca muda seu estado de matéria. Portanto, você nunca ouvirá o termo vapor de dióxido de carbono; é sempre conhecido como gás dióxido de carbono.
O que é vapor?
O vapor é um tipo de gás que está no estado de equilíbrio entre gás e água; ele pode retornar ao seu estado líquido original se a pressão for aplicada e a temperatura for mantida constante. O estado original do vapor também pode ser sólido, então o vapor em sua fase neutra à temperatura ambiente deve ser líquido ou sólido. Os vapores são mais facilmente compressíveis em comparação com os gases, pois estão em constante transição. Quando o vapor tem que retornar ao seu estado original, a pressão é necessária e a mudança de temperatura não é necessária. Vapor é o termo usado para a molécula gasosa que pode ser o líquido à temperatura ambiente. A água evaporada da água é descrita como vapor de água e, quando a pressão é exercida pelo vapor de água, ela retorna ao estado líquido. Em outras palavras, o vapor de água é a água presente no estado gasoso. Os vapores são visíveis a olho nu à medida que ocorre a mudança física neles.
Gás vs. Vapor
- O gás é um dos quatro estados da matéria, enquanto o vapor é um estado gasoso em que está no estado de equilíbrio entre gás e líquido.
- O gás não mudaria seu estado à temperatura ambiente ou no estado neutro. Ao contrário disso, à temperatura ambiente, o vapor retorna ao seu estado original, que é líquido ou sólido.
- A mudança de temperatura e pressão é necessária para mudar a fase do gás. Por outro lado, uma mudança de pressão é necessária para retornar o vapor ao estado original.
- O gás não pode ser visto a olho nu, enquanto os vapores são visíveis a olho nu, pois estão em constante transição.
Vídeo Comparativo